Gaswetten
1. Gaswetten (WB Th4 H3 ↗189-199)
1.1. De Wet
\[p\cdot V = n \cdot R \cdot T\]
- kennen!
- gebruiken!
- RiCo: gasconstante R = \(8,31 \frac{J}{K\cdot mol}\)
- verder lezen, verder lezen!
1.2. toestandsgrootheden
1.3. Normomstandigheden
https://nl.wikipedia.org/wiki/Standaardomstandigheden
- \(101325 Pa\)
- \(0^{\circ}C\)
- \(22.4 \frac{L}{mol}\)
bereken R voor een zelf gekozen situatie!
1.4. omzetten van \(pV=nRT\)
opdracht: zet de formule om naar alle variabelen!
- \(p = \ldots\)
- \(V = \ldots\)
- \(n = \ldots\)
- \(R = \ldots\)
- \(T = \ldots\)
1.5. ideaal gas?
Wat is een ideale gas?
- zwaartekracht
- intermoleculaire krachten
1.6. absoluut nul?
Wat gebeurt bij dit wet als het gas dichter bij \(0 K\) komt?
1.7. hoe zit het met vloeistoffen?
- samendrukbaarheid!?
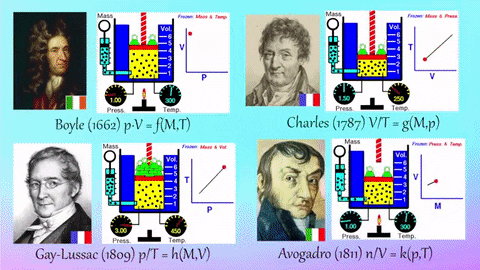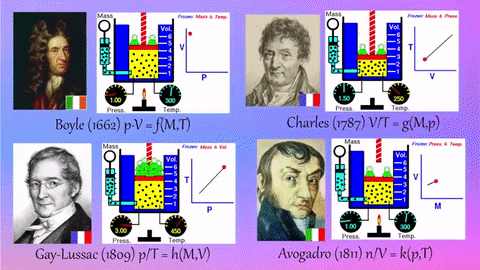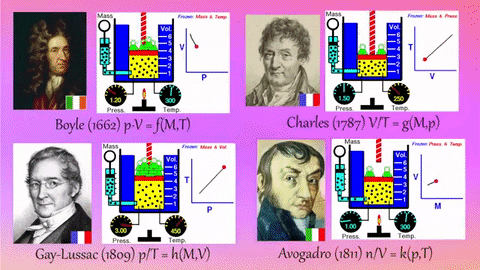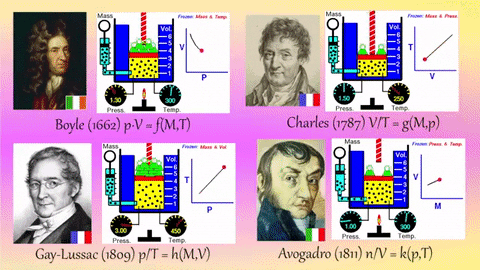
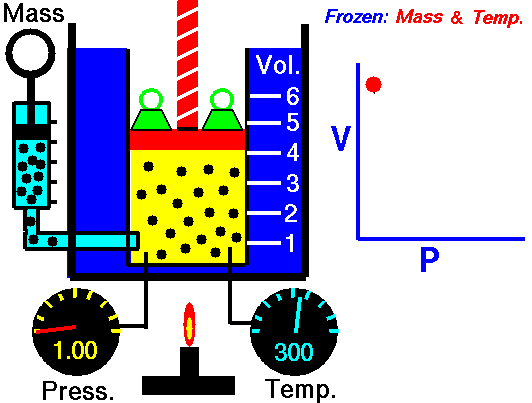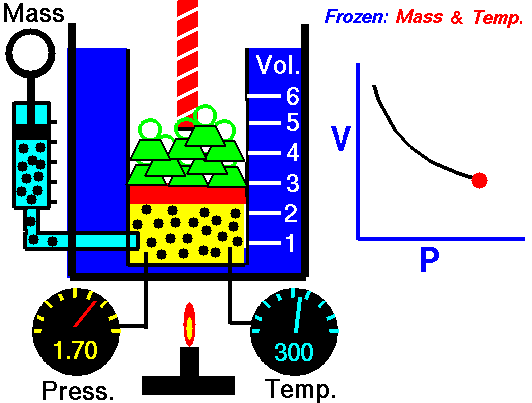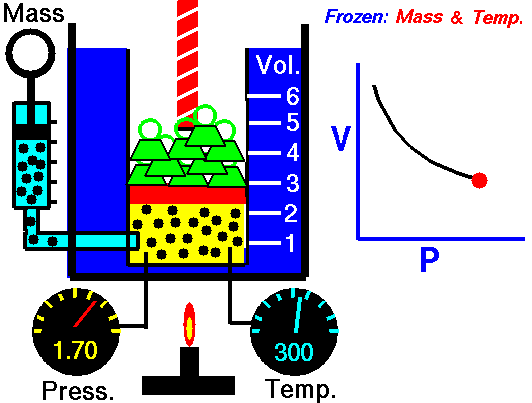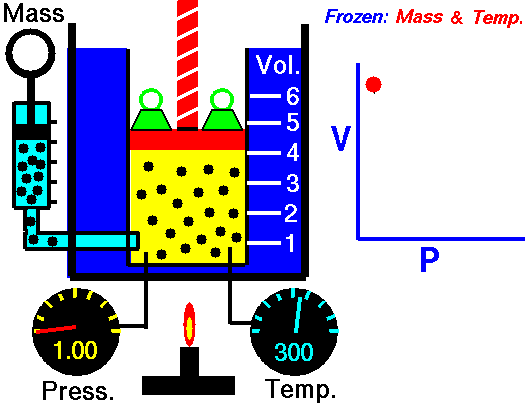
1.8. Boyle-Maryotte
- https://en.wikipedia.org/wiki/Boyle%27s_law
- samenhang tussen druk en volume
- denk aan een open duikbood
1.9. Charles:
- https://en.wikipedia.org/wiki/Charles%27s_law
- samenhang tussen temperatuur en volume
- denk bv. aan een heteluchtballon

1.10. Gay-Lussac
- https://en.wikipedia.org/wiki/Gay-Lussac%27s_law#Pressure-temperature_law
- samenhang tussen temperatuur en druk
- denk aan een hogedruk-snelkookpan
1.11. Avogadro
- https://en.wikipedia.org/wiki/Avogadro%27s_law
- deeltjesaantal en druk
- denk aan een luchtballon