Elektronegativiteit, Polariteit, en Oplosbaarheid
1. Chemie: Polariteit (Th4 ↗91)
1.1. Herhaling: PSE
(!) Alles staat in de PSE (periodiek systeem van de elementen)
- Waarom is het PSE “periodiek”?
- Wat staat in de rijen/kolomnen?
PSE altijd meebrengen!
1.2. ElektroNegatieve Waarde (EN)
Definitie:
De elektronegativiteit (EN) of elektronegatieve waarde (ENW) is een maat voor de neiging van een atoom om elektronen naar zich toe te trekken.

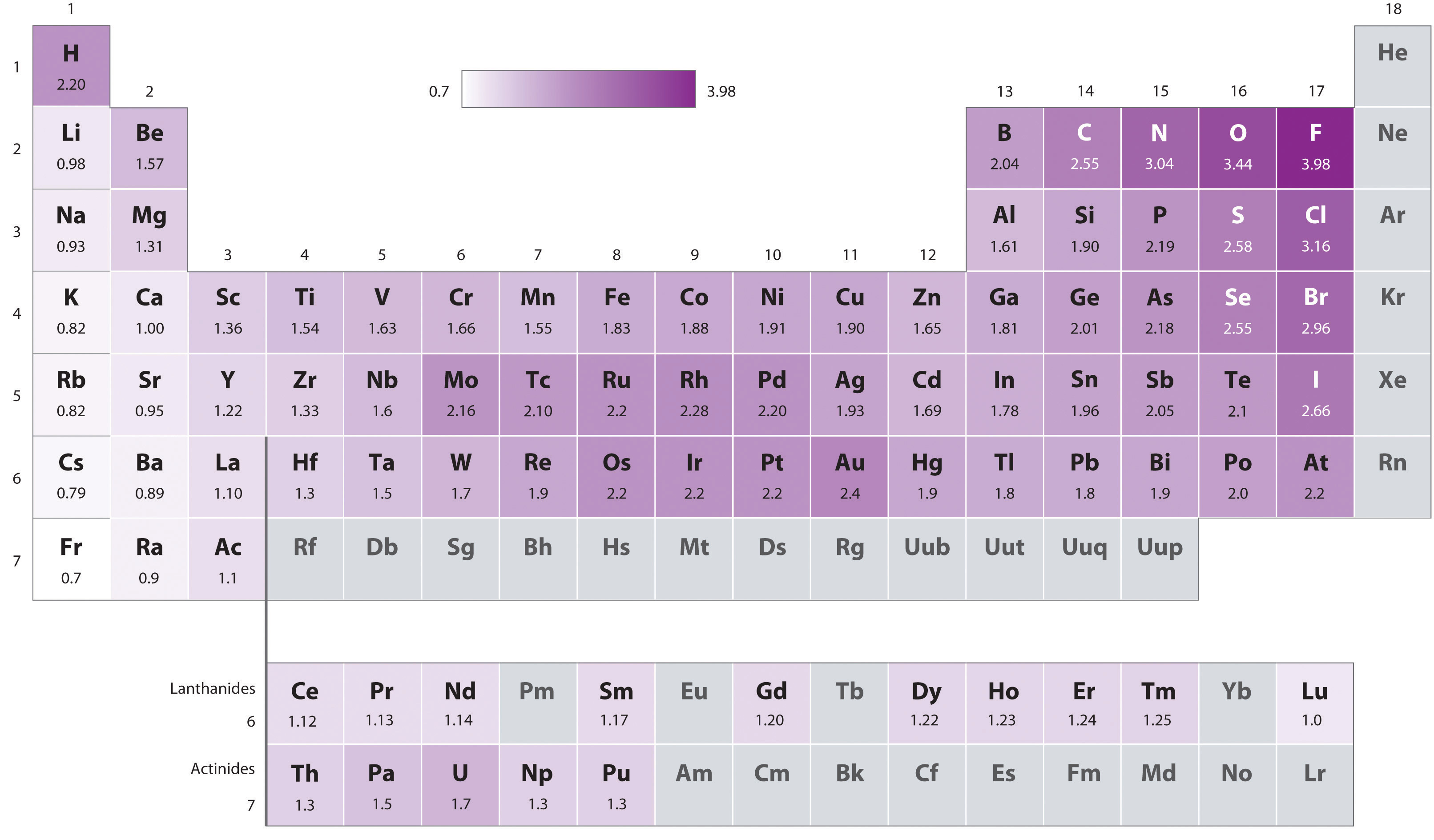 [1]
[1]
1.3. Verschil in Elektronegativiteit
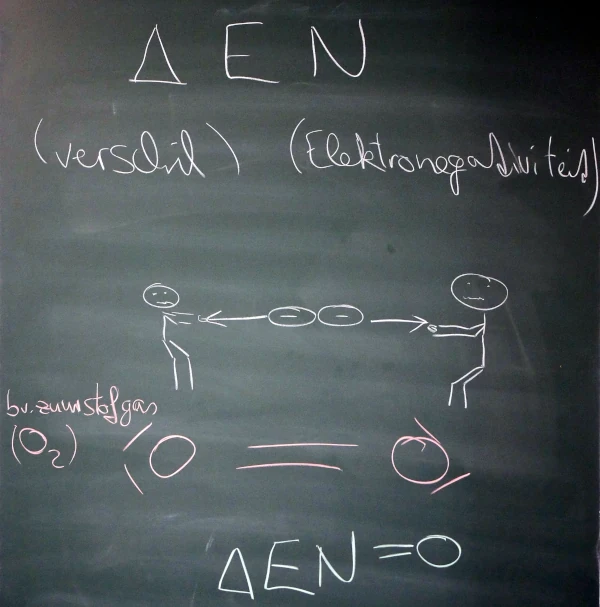

1.4. Herhaling: Binding en Verbinding
1.5. Polariteit
- neem de Lewis-Structuur (elementsymbolen met stipjes en streepjes)
- bepaal de ENW van alle elementen
- bereken per binding het verschil in ENW = ΔEN
- polariteit van de bindingen:
- bepaal de polariteit van elke binding (zie tabel boven)
- polariteit van de verbinding / molecuul:
- indien er geen polaire bindingen aanwezig zijn, is het molecuul als geheel apolair.
- indien één of meer bindingen polair zijn, is het molecuul meestal polair…
- (uitzondering: symmetrie in de 3D-Structuur, bv. kooldioxide \(CO_2\) of tetrafluoromethaan \(CF_4\).)

2. Oefening
Vul de volgende tabel aan!
| Element | Elektronegativiteit |
|---|---|
| H | \(\quad\quad\quad\quad\quad\quad\) |
| C | |
| Cl | |
| S | |
| O | |
| Br | |
- Bereken het verschil in elektronegativiteit van elementen met zuurstof en waterstof!
| Element | \(\Delta EN\) | \(\Delta EN\) |
|---|---|---|
| Element | Waterstof (\(H\)) | Zuurstof (\(O\)) |
| C | \(\quad\quad\quad\) | \(\quad\quad\quad\) |
| Cl | ||
| S | ||
2.1. backup
- Duid de polaire bindingen in de volgende stoffen aan!
- Zijn de moleculen (en daarom de stoffen) polair of apolair?

3. Samenvatting
- Je kent de definitie van Elektronegativiteit.
- Je kan EN-waardes in de PSE vinden.
- Je berekend het verschil in elektronegativiteit.
- Je weet wat bindingen en verbindingen zijn.
- Je bepaalt de polariteit van bindingen op basis van ΔEN (verschil in EN, grenswaardes \(0,5\) en \(1,6\)).
- Je besluit of een stof/verbinding/molecuul polair is.
vorige les \(\quad\) volgende les

