Oxidatiegetalen
1. Oxidatiegetalen = Elektronenboekhouding! (T4 H3 ↗107)
Voorbeeld:
- \(H_2SO_4\)

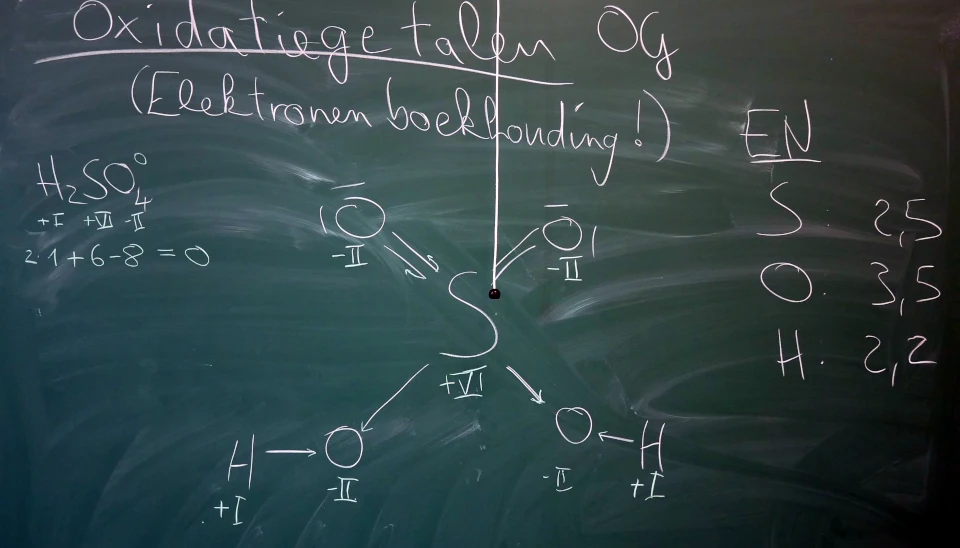
Stappen:
- Bepaal de EN van de atomen in een verbinding/molecuul (O: 3,5; S: 2,5, H: 2,2)! Kijk naar de Lewis-structuur welke elementen verbonden zijn.
- Begin met het element met de hoogste EN! Deze verdeelt met de omliggende elementen elektronen tot op edelgasconfiguratie. (bv. zuurstof → +2 elektronen → OG \(-II\))
- Herhaal voor de andere atomen, van hoge naar lage EN. De overgangsmetalen houden we over tot op het einde. (bv. \(H\): \(+I\), S: \(+VI\))
- Controle: de som van alle OG moet gelijk zijn aan de lading van het molecuul!

Observaties:
- Waterstof kan enkel 1 elektron afstaan.
- Enkelvoudige stoffen hebben een OG van gemiddeld \(\pm 0\).
- Elementen met hoge EN gaan vaak elektronen bijkrijgen (bv. fluor, zuurstof, chloor…) tenzij in verbinding met nog sterkere EN (bv. zuurstoffluoride \(OF\)).
probeer ook:
- \(HSO_4^-\)
2. Oefening: Bepaal de OG!
- \(O_2\)
- \(Fe^{2+}\)
- \(MgO\)
- \(PbI_2\)
- \(Na^+\), \(Cl^-\), \(NaCl\)
- …