Warmte en Temperatuur
1. Herhaling: Joule-Effect (Th3 H4.2 ↗91)
- stroom: elektronen bewegen
- weerstand: elektronen botsen
- elektrische potentiele energie -> warmte
warmte is energie!
2. Warmte
- voorwerpen hebben een inwendige energie (potentiële en kinetische)
- een voorwerp is “warm” als een andere voorwerp energie ervan kan krijgen
- een voorwerp is “koud” als het energie krijgt van een andere voorwerp
Warmte is het energieverschil en per gevolg een energieuitwisseling tussen twee voorwerpen.
| Warmte | (Energie) |
| symbool | \(Q\) |
| eenheid | \(J = Nm\) |
Noot: alle deeltjes streven naar de laagst mogelijke energie.
- Een verschil in energie gaat een uitwisseling (warmte!) veroorzaken.
- voorbeeld: ijsberg in water
per gevolg:
3. Thermisch Evenwicht
3.1. Het Nulde Wet
Het “Nulde Wet van de Thermodynamica”:


Als A in thermisch evenwicht is met B en B met C, dan is A ook in thermisch evenwicht is met C.
3.2. Toepassing
4. Temperatuur
- De inwendige kinetische energie van een stof is de snelheid van de deeltjesbeweging.
- Temperatuur \(\theta\) is een maat voor de gemiddelde snelheid van de deeltjes.
| Temperatuur | |
| symbool | \(\theta\) |
| eenheid 1 | \(^{\circ}C\) |
| eenheid 2 | \(K\) |
Dankzij het Nulde Wet (zie boven) kunnen we referentiewaardes kiezen:
- bv. het vriespunt van water en de lichaamstemperatuur van een gezond persoon, gemeten in de mond of onder de oksel (Farenheit) → onhandig.
- bv. smelt- en kooktemperatuur van water → beter, maar heeft geen nul (Celsius).
- geen deeltjesbeweging (\(0 K\)) en het vriespunt van water (\(273,15 K\)) → Kelvin-schaal
5. Oefening
- 1 kg water van 10ºC wordt toegevoegd aan 10 kg water van 50ºC. Wat is de temperatuur van het water wanneer het thermisch evenwicht bereikt?
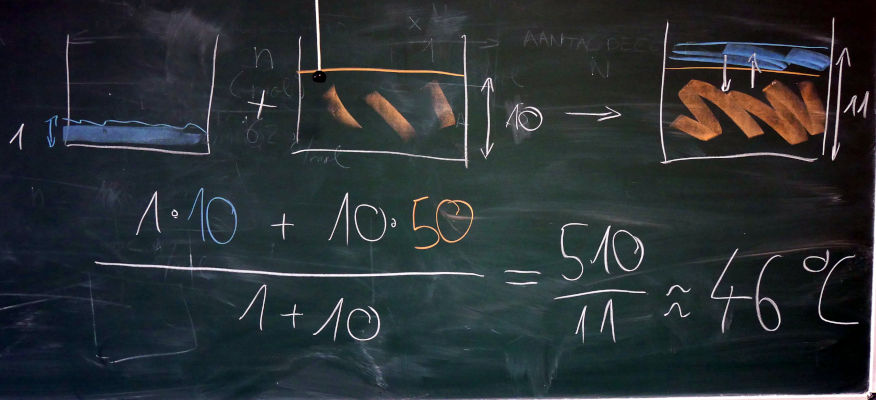
- formule van het gewogen gemiddelde toepassen
- Dit mag omdat de massa direct gerelateerd is aan het aantal deeltjes, en de temperatuur is een lineair maat voor de deeltjesbeweging.
6. Samenvatting
vandaag hebben we gezien:

7. Bronnen
- https://ocw.mit.edu/courses/5-60-thermodynamics-kinetics-spring-2008/resources/lecture-1-state-of-a-system-0th-law-equation-of-state
- https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Thermodynamics/The_Four_Laws_of_Thermodynamics/0th_Law_of_Thermodynamics
vorige les \(\quad\) labo \(\quad\) volgende les
