Labo: Oefening Polariteit
1. Overzicht
We zijn met de volgende oefening begonnen:
… maar er bleek nog wat theorie nodig. We gaan erop terug komen.
2. Demo: Polariteit en Oplosbaarheid
- geleidbaarheid van water;
- oplosbaarheid (dissociatie) en geleidbaarheid van keukenzout
- geleidbaarheid van zoutzuur
3. Overzicht: Elektronegativiteit
3.1. Begrippen
- binding (= “streepje tussen atomen”)
- verbinding (= “het geheel”, versameling van gelijkachtige moleculen)
- elektronegativiteit/elektronegatieve waarde (= “hoeveel een element elektronen naar zich toe trekt”)
- elektrolyt
- ionisatie/dissociatie
3.2. Stappenplan
- teken de Lewis-Structuur (elementsymbolen met stipjes en streepjes)
- bepaal de ENW van alle elementen
- bereken per binding het verschil in ENW = ΔEN
- polariteit van de bindingen:
- bepaal de polariteit van elke binding (zie tabel beneden)
- indien polair: teken er deelladingen \(\delta +,\ \delta -\) per binding
- polariteit van de verbinding / molecuul:
- indien er geen polaire bindingen aanwezig zijn, is het molecuul als geheel apolair.
- indien één of meer bindingen polair zijn, is het molecuul meestal polair…
- tenzij door symmetrie in de 3D-Structuur de deelladingen elkaar negeren (bv. kooldioxide \(CO_2\), tetrafluoromethaan \(CF_4\)).
Uit ΔEN en per gevolg polariteit laten zich een heleboel eigenschappen afleiden, bv.
- bindingstype
- intermoleculaire krachten
- oplosbaarheid
- dissociatie, ionisatie
- geleidbaarheid
- aggregatietoestand
- oxidatiegetallen
- mogelijke reacties met andere stoffen
3.3. Overzicht
| \(\Delta EN < 0,5\) | covalente binding | apolair | (slecht oplossbar in polaire oplosmiddelen) |
| \(0,5 \le \Delta EN < 1,5\) | covalente binding | polair | ionisatie |
| \(\Delta EN \ge 1,5\) | ionenbinding | polair | dissociatie |
Waarom die grenswaarden? → We kunnen polariteits-eigenschappen van verbindingen meten.
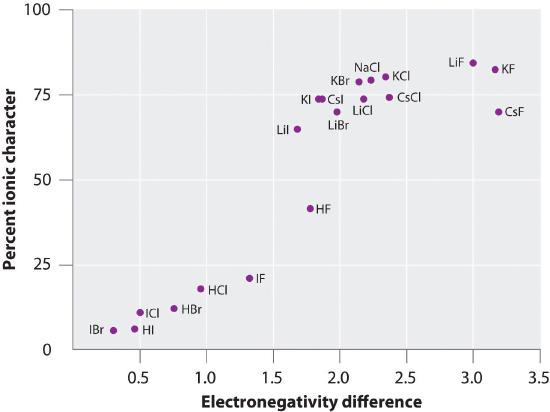 [bron]
[bron]
3.4. Voorbeelden

3.5. verder lezen
voor geïnteresseerden: Linus Pauling