Warmte en Temperatuur
1. Warmte
- voorwerpen hebben een inwendige energie (potentiële en kinetische)
- een voorwerp is “warm” als een andere voorwerp energie ervan kan krijgen
- een voorwerp is “koud” als het energie krijgt van een andere voorwerp
Warmte is het energieverschil en per gevolg een energieuitwisseling tussen twee voorwerpen.
| Warmte | (Energie) |
| symbool | \(Q\) |
| eenheid | \(J = Nm\) |
Noot: alle deeltjes streven naar de laagst mogelijke energie.
- Een verschil in energie gaat een uitwisseling (warmte!) veroorzaken.
- voorbeeld: ijsberg in water

per gevolg:
2. Thermisch Evenwicht
2.1. Het Nulde Wet
Het “Nulde Wet van de Thermodynamica”:

Als A in thermisch evenwicht is met B en B met C, dan is A ook in thermisch evenwicht is met C.
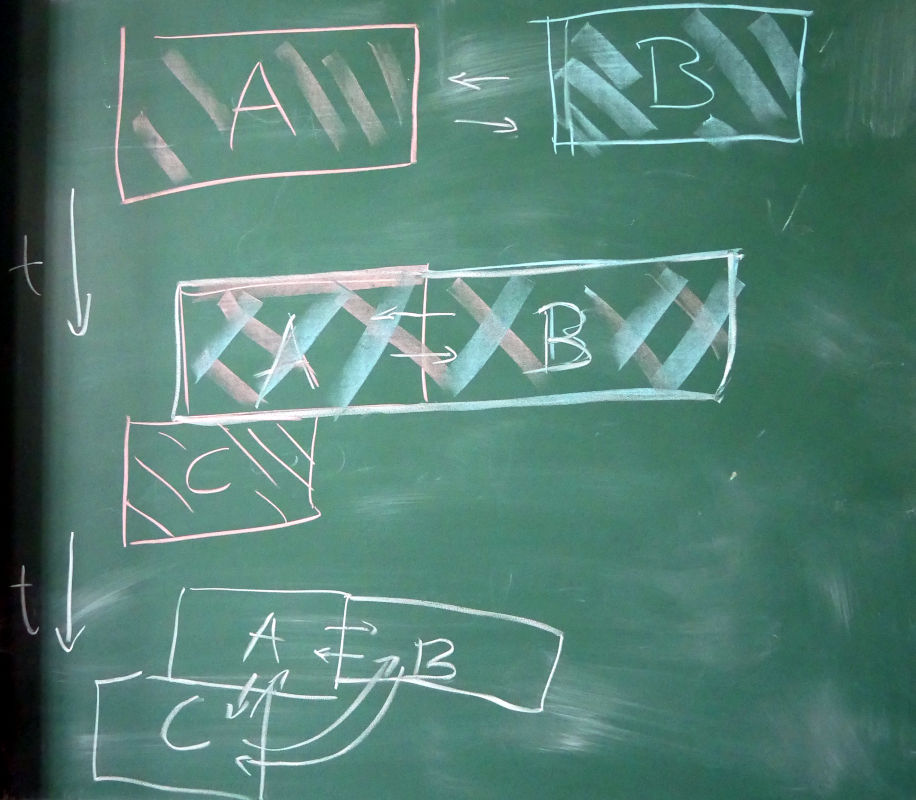
2.2. Toepassing
3. Temperatuur
- De inwendige kinetische energie van een stof is de snelheid van de deeltjesbeweging.
- Temperatuur \(\theta\) of \(T\) is een maat voor de gemiddelde snelheid van de deeltjes.
| Temperatuur | |
| symbool | \(\theta\) |
| eenheid 1 | \(^{\circ}C\) |
| eenheid 2 | \(K\) |
Dankzij het Nulde Wet (zie boven) kunnen we referentiewaardes kiezen:
- bv. het vriespunt van water en de lichaamstemperatuur van een gezond persoon, gemeten in de mond of onder de oksel (Farenheit) → onhandig.
- bv. smelt- en kooktemperatuur van water → beter, maar heeft geen nul (Celsius).
- geen deeltjesbeweging (\(0 K\)) en het vriespunt van water (\(273,15 K\)) → Kelvin-schaal

4. Oefening
→ WB Th4 H1 Warmte ↗150
5. Samenvatting
vandaag hebben we gezien:

(+ het “nulde wet”)
