Chemie: Polariteit en Oplosbaarheid
1. Oefening (WB Th6 H3 ↗233)
- p.233 oef4 - p.238 oef21
2. Chemie: Polariteit (Th4 ↗91)
2.1. Herhaling: PSE
(!) Alles staat in de PSE (periodiek systeem van de elementen)
- Waarom is het PSE “periodiek”?
- Wat staat in de rijen/kolomnen?
PSE altijd meebrengen!
2.2. ElektroNegatieve Waarde (EN)
Definitie:
De elektronegativiteit (EN) of elektronegatieve waarde (ENW) is een maat voor de neiging van een atoom om elektronen naar zich toe te trekken.

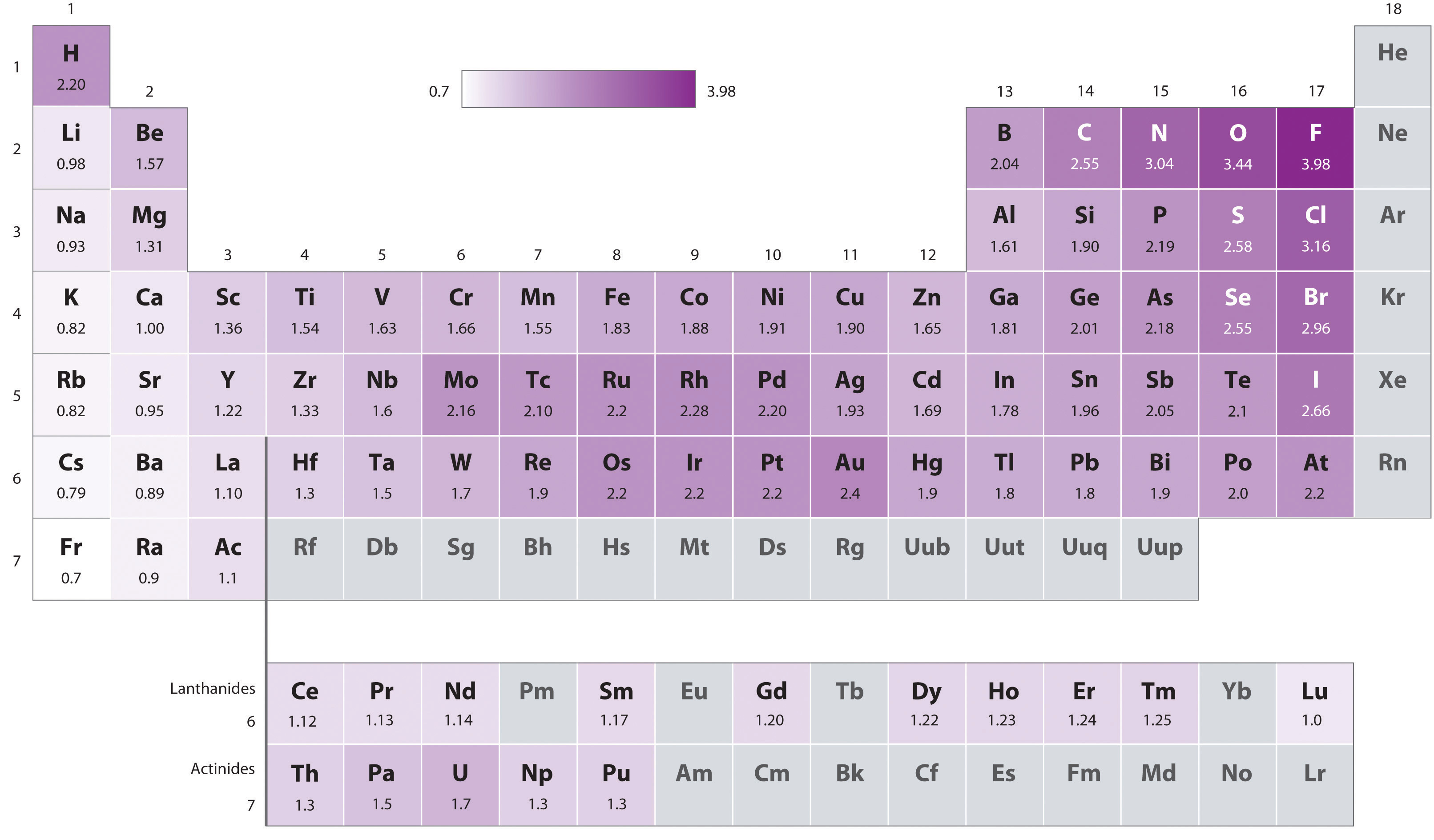 [1]
[1]
2.3. Verschil in Elektronegativiteit
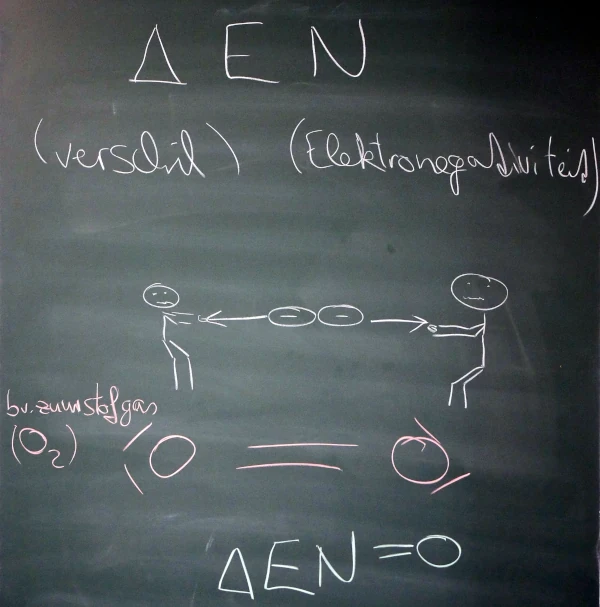

3. Oefening
Vul de volgende tabel aan!
| Element | Elektronegativiteit |
|---|---|
| H | \(\quad\quad\quad\quad\quad\quad\) |
| C | |
| Cl | |
| S | |
| O | |
| Br | |
- Bereken het verschil in elektronegativiteit van elementen met zuurstof en waterstof!
| Element | \(\Delta EN\) | \(\Delta EN\) |
|---|---|---|
| Element | Waterstof (\(H\)) | Zuurstof (\(O\)) |
| C | \(\quad\quad\quad\) | \(\quad\quad\quad\) |
| Cl | ||
| S | ||
4. Samenvatting
- Je kent de definitie van Elektronegativiteit.
- Je kan EN-waardes in de PSE vinden.
- Je berekend het verschil in elektronegativiteit.
- Je weet wat bindingen en verbindingen zijn.
5. Bronnen
- [1] https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/08%3A_Basic_Concepts_of_Chemical_Bonding/8.04%3A_Bond_Polarity_and_Electronegativity
- [2] N.J. Tro (2021): “Chemistry - A Molecular Approach”, Pearson Global Edition, 5th ed.; p.451, afb. 10.9
vorige les \(\quad\) volgende les

