Chemie: Polariteit en Oplosbaarheid
1. Verbetering: Oefening I
Vul de volgende tabel aan!
| Element | Elektronegativiteit |
|---|---|
| H | \(\quad\quad\quad\quad\quad\quad\) |
| C | |
| Cl | |
| S | |
| O | |
| Br | |
- Bereken het verschil in elektronegativiteit van elementen met zuurstof en waterstof!
| Element | \(\Delta EN\) | \(\Delta EN\) |
|---|---|---|
| Element | Waterstof (\(H\)) | Zuurstof (\(O\)) |
| C | \(\quad\quad\quad\) | \(\quad\quad\quad\) |
| Cl | ||
| S | ||
2. Verschil in EN: ΔEN
2.1. Tabel te kennen!
| Verschil EN | Bindingstype | Polariteit | Oplossing in Water |
|---|---|---|---|
| ΔEN < 0,5 | covalente binding | apolair | slecht oplossbar |
| 0,5 ≤ ΔEN < 1,6 | covalente binding | polair | goed oplosbaar |
| 1,6 ≤ ΔEN | ionenbinding | polair | goed oplosbaar |
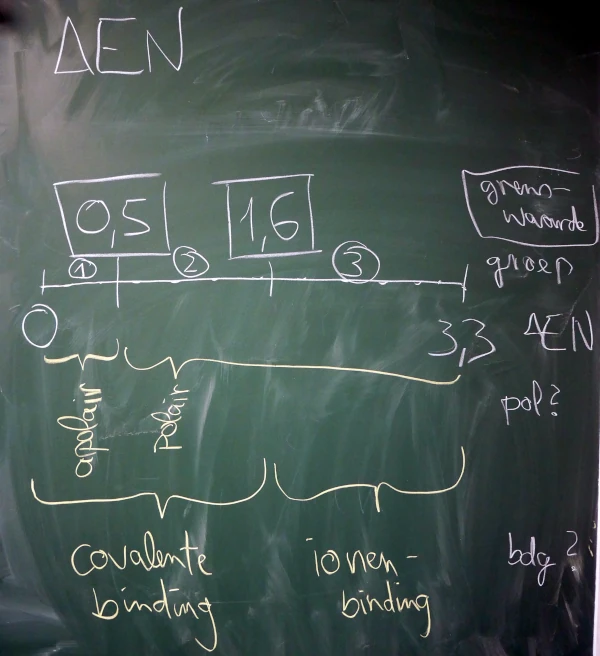

2.2. Uitbreiding: Bindingstypes
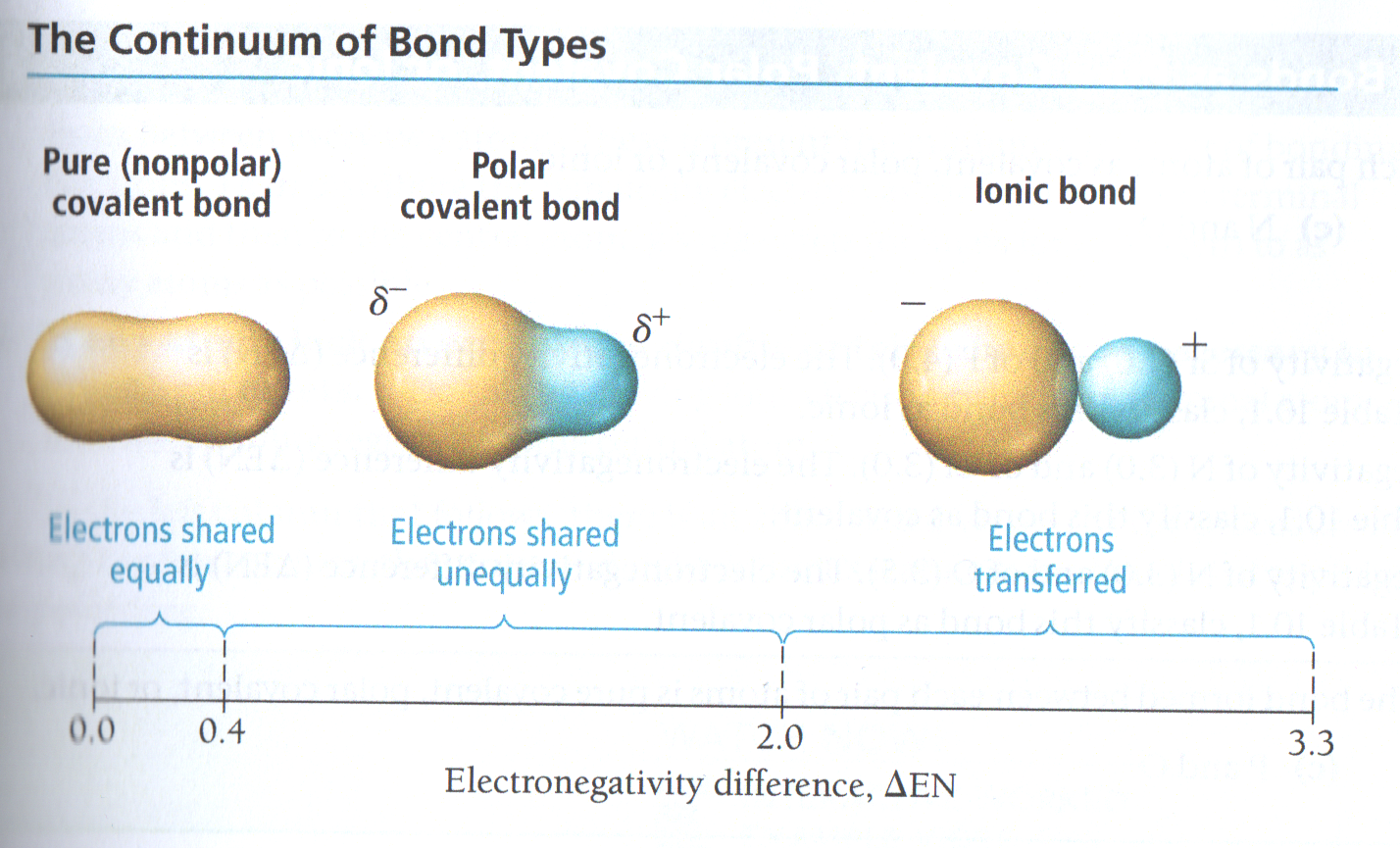 [2]
[2]
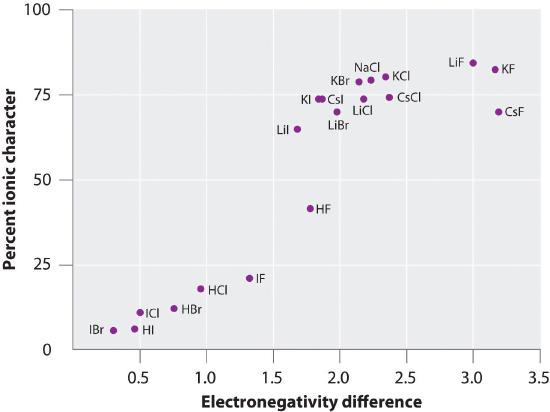 [3]
[3]
3. Polariteit
- neem de Lewis-Structuur (elementsymbolen met stipjes en streepjes)
- bepaal de ENW van alle elementen
- bereken per binding het verschil in ENW = ΔEN
- polariteit van de bindingen:
- bepaal de polariteit van elke binding (zie boven)
- polariteit van de verbinding / molecuul:
- indien er geen polaire bindingen aanwezig zijn, is het molecuul als geheel apolair.
- indien één of meer bindingen polair zijn, is het molecuul meestal polair…
- (uitzondering: symmetrie in de 3D-Structuur, bv. kooldioxide \(CO_2\) of tetrafluoromethaan \(CF_4\).)
4. Oefening II
- Duid de polaire bindingen in de volgende stoffen aan!
- Zijn de moleculen (en daarom de stoffen) polair of apolair?

5. Water (LB Th4 H1 ↗91-94)

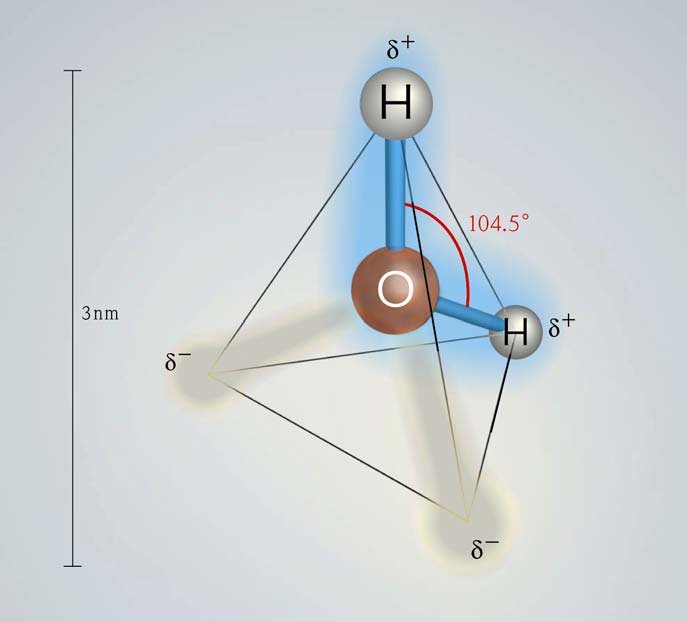 [5]
[5]
6. Oefening (WB Th4 H1 ↗135+)
→ oefeningen WB p.135+
7. Bronnen
- [1] https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/08%3A_Basic_Concepts_of_Chemical_Bonding/8.04%3A_Bond_Polarity_and_Electronegativity
- [2] N.J. Tro (2021): “Chemistry - A Molecular Approach”, Pearson Global Edition, 5th ed.; p.451, afb. 10.9
- [3] https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/08%3A_Basic_Concepts_of_Chemical_Bonding/8.04%3A_Bond_Polarity_and_Electronegativity
- [4]
- [5] https://www.researchgate.net/figure/Molecular-geometry-of-a-water-molecule-The-molecular-shape-is-an-almost-symmetrical_fig1_272264075
vorige les \(\quad\) volgende les