Intermoleculaire Krachten
1. Intermoleculaire Krachten
1.1. ⌘ Sleutelconcept
allemaal elektromagnetische (dipool-) interacties (= Coulomb-kracht)
spelers:
- ionen (ΔEN > 1,5)
- permanente dipolen = “deelladingen” (1,5 > ΔEN > 0,5)
- tijdelijke dipolen (ΔEN < 0,5)
 [1]
[1]
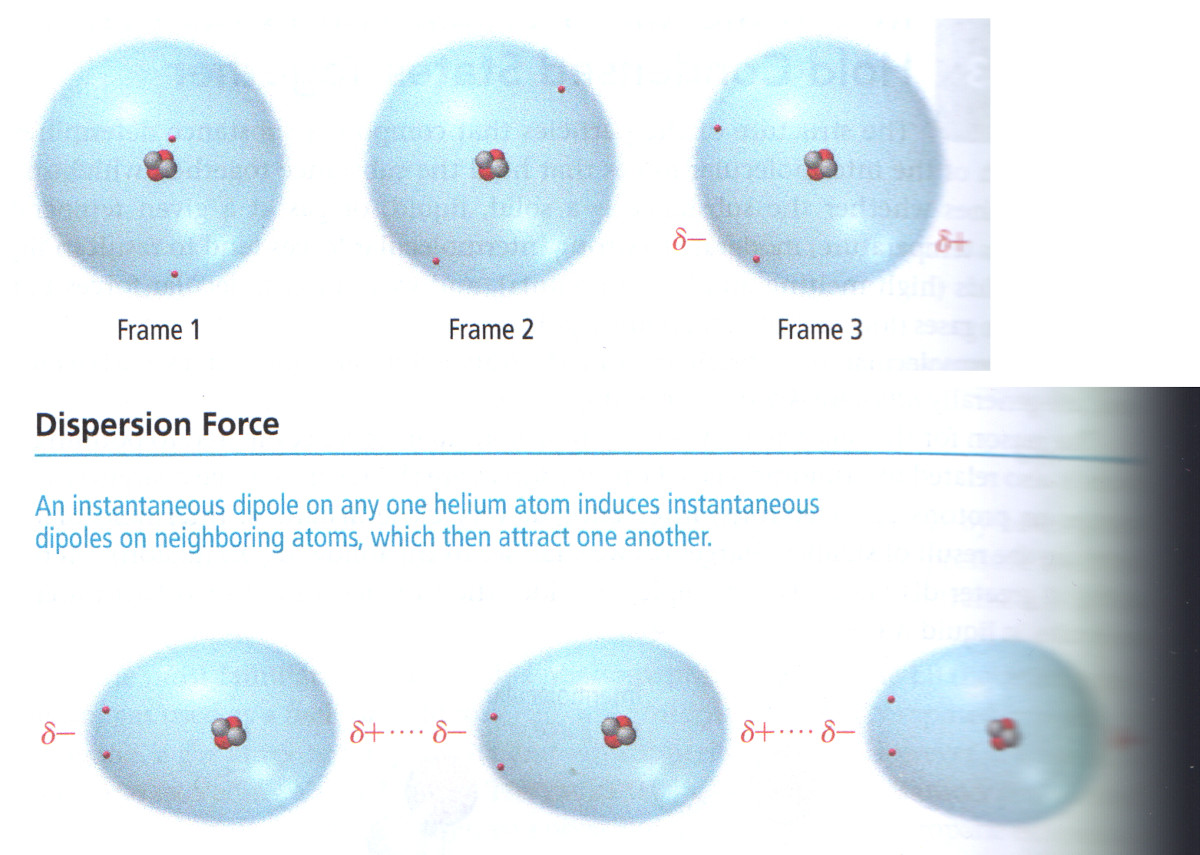
Hoe meer ladingsverschil, hoe groter de kracht (tijdelijk < permanent < ion)
1.2. Buitenbeentje: Waterstofbrug
- een waterstofion is een proton
- grote lading (+1), maar zwaarder en minder bewegelijk dan elektronen
- indien de elektronen van een wateratom weggetrokken worden, blijft relatief statische positieve lading achter.
→ komen voor waar waterstof aan een elektronegatief element met vrije elektronenparen gebonden is.
1.3. Oefening Polariteit
- Zijn de volgende verbindingen polair of apolair? Bepaal de deelladingen voor alle polaire bindingen.
- Gaan de stoffen oplossen in een polaire oplosmiddel? Indien ja: is het een dissociatie of ionisatie?
- Welke intermoleculaire krachten zijn er aanwezig?
stoffen:
- Water \(H_2O\)
- Tetrafluormethaan \(CF_4\)
- Ammoniak \(NH_3\)
- Kaliumchloride \(KCl\)
- Mierenzuur \(HCOOH\)
- Aceton \(CH_3COCH_3\)
- Zuurstofgas \(O_2\)
- Silaan \(SiH_4\)
1.4. Toepassing: Dissociatie
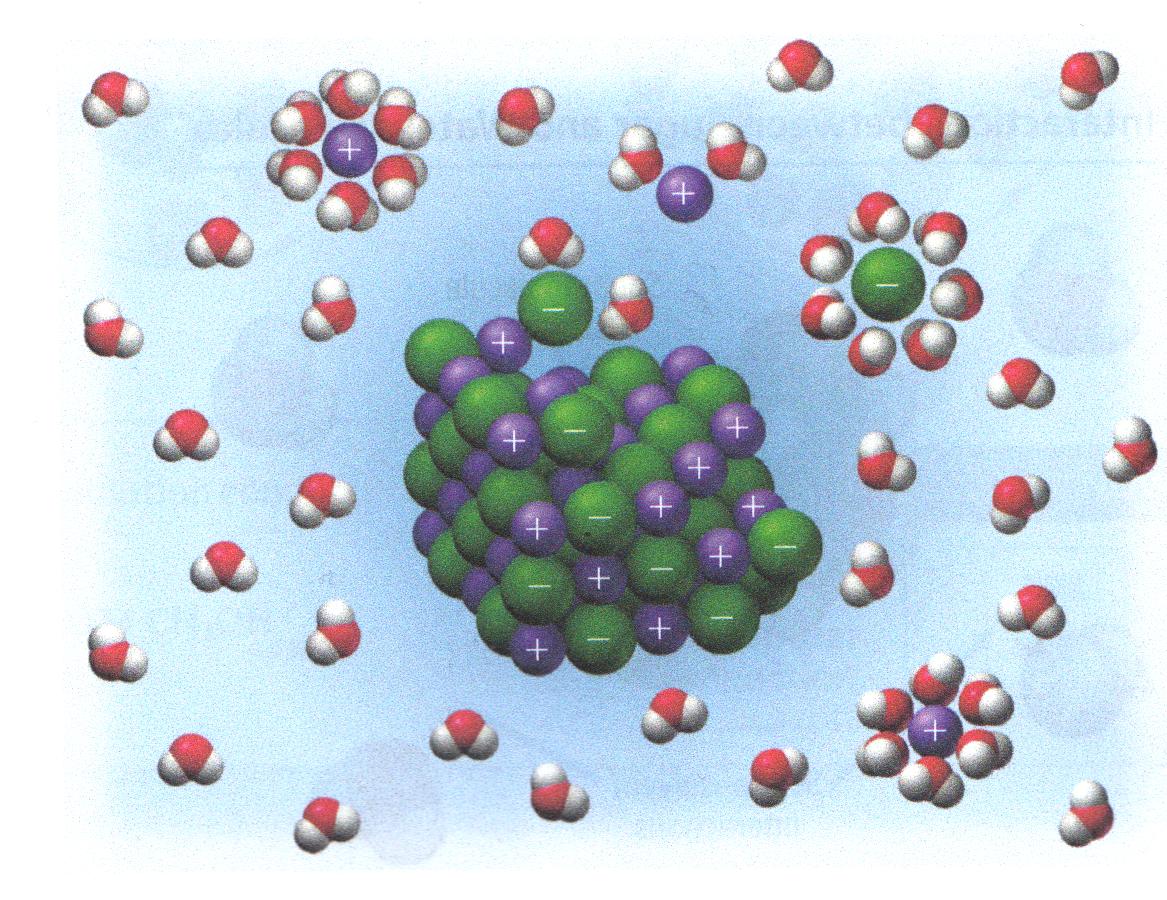
- Ion-Ion-krachten in zoutrooster
- Ion-Dipol-krachten bij zoutoplossing
 [2]
[2]
2. Bronnen
- [1] N.J. Tro (2021): “Chemistry - A Molecular Approach”, Pearson Global Edition, 5th ed.; p.542
- [2] N.J. Tro (2021): “Chemistry - A Molecular Approach”, Pearson Global Edition, 5th ed.; p.217
vorige les \(\quad\) labo \(\quad\) volgende les