Aggregatietoestand
1. TL;DR
- herhaling molaire massa
- temperatuur \(\theta\) en kookpunt \(\theta_k\)
- twee effecten op kook- en smelttemperatuur:
- molaire massa (deeltjesbeweging)
- intermoleculaire krachten
Leerpad: hier.
2. Intermoleculaire Krachten en Aggregatietoestand
2.1. Temperatuur
- deeltjesbeweging
Temperatuur is deeltjesbeweging!
analogie: leerlingen
- vast = in de klas: iedereen op zijn plaats, maar lokaal beweging
- vloeibaar = buiten, schoolplein: wel samen, maar iedereen loopt rond, we komen elkaar tegen
- gas = na de school: grote afstanden, iedereen vrij, weinig interactie maar soms toevallige botsingen
toepassing:
- hoe groter de (moleculaire) massa, hoe groter is ook de kooktemperatuur
- voorbeeld 1: edelgassen
edelgas mol. massa kookpunt \(M\ [g/mol]\) \(\theta_k\ [K]\) He 4 4 Ne 20 27 Ar 40 87 Kr 84 120 Xe 131 165 bron [1]
- voorbeeld 2: halogenen
→ WB p.53 oef. 25
- voorbeeld 3: n-alkanen
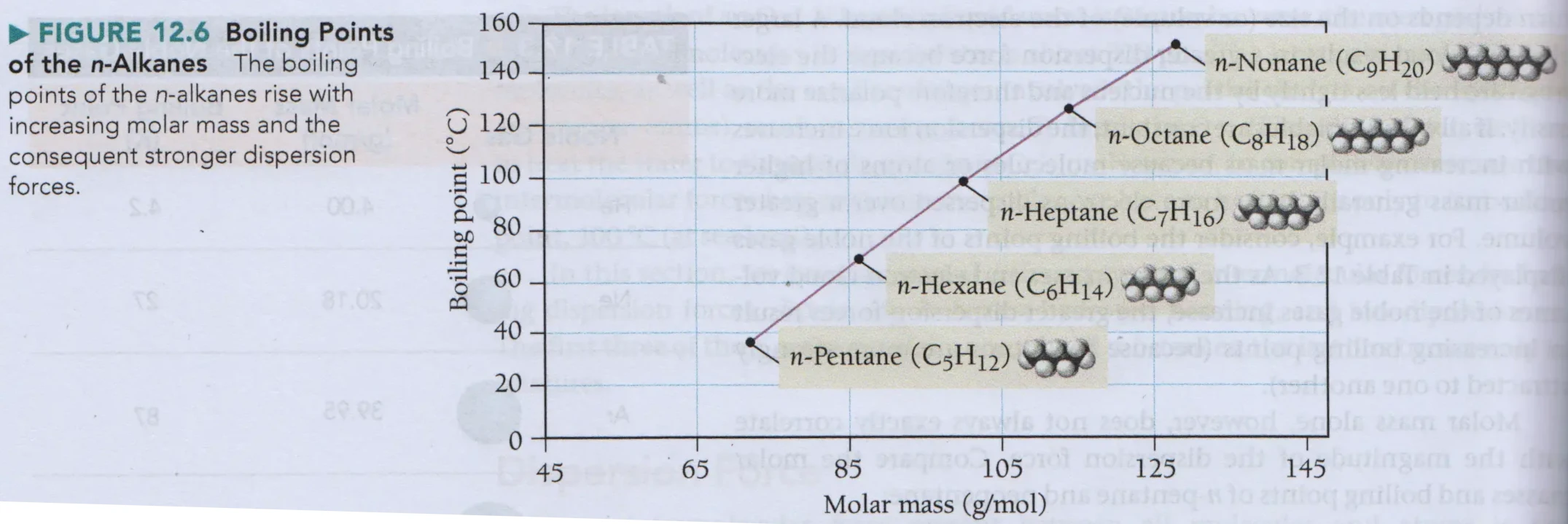 [1]
[1]
2.2. intermoleculaire krachten
- voorbeeld 1:
- kooktemperatuur van n-pentaan en neopentaan (=dimethylpropaan)
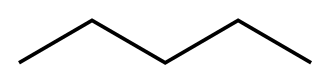
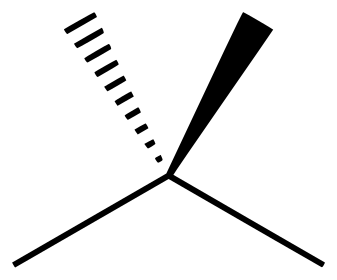
n-pentaan neopentaan \(C_5H_{12}\) \(C_5H_{12}\) mol. massa \(M\) \(72,15\frac{g}{mol}\) \(72,15\frac{g}{mol}\) kookpunt \(\theta_{k}\) 36,1℃ 9,5℃ Waarom? → intermoleculaire krachten zijn groter bij lineaire moleculen (grotere contaktoppervlak)
- over welke intermoleculaire krachten gaat het hier?
- voorbeeld 2:
- kooktemperatuur van ethanol en dimethylether
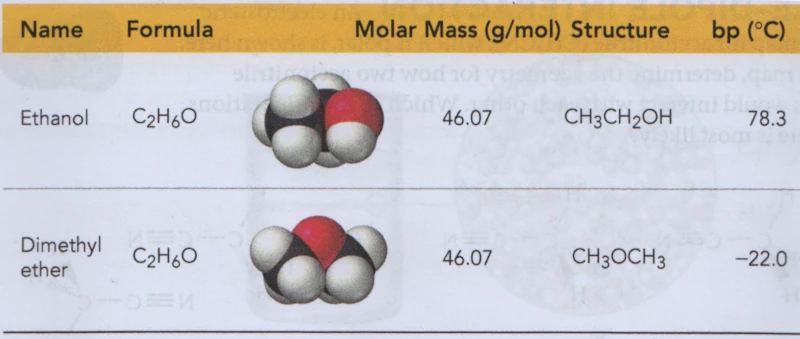 [2]
[2]
ethanol dimethylether \(C_2H_6O\) \(C_2H_6O\) mol. massa \(M\) \(46.07\frac{g}{mol}\) \(46.07\frac{g}{mol}\) kookpunt \(\theta_{k}\) 78,3℃ -22,0℃ - over welke intermoleculaire krachten gaat het hier?
2.3. Oefening
De volgende tabel toont kookpunten van verbindingen van elementen uit de zuurstof- en koolstofgroepen met waterstof (normale, atmosferische omstandigheden).
- (bron: [2], https://pubchem.ncbi.nlm.nih.gov)
| Stof | Mol. Massa | Kookpunt |
|---|---|---|
| Waterstofoxide \(H_2O\) | 18 g/mol | |
| Waterstofsulfide \(H_2S\) | 34 | -60 °C |
| Waterstofselenide \(H_2Se\) | 81 g/mol | -41 °C |
| Waterstoftelluride \(H_2Te\) | 130 | -2 °C |
| Methaan \(CH_4\) | 16 g/mol | −188 °C |
| Silaan \(SiH_4\) | −112 °C | |
| Germaan \(GeH_4\) | 77 g/mol | −89 °C |
| Stannaan \(SnH_4\) | −52 °C | |
- Bereken de molaire massa van de stoffen en vul de tabel aan.
- Breng de meetpunten over naar een diagram: x-as “molaire massa” \(0
- Hoe is de samenhang te verklaren?
- Vul aan: water. Waarom is water een uitzondering?
3. Bronnen
- [1] N.J. Tro (2021): “Chemistry - A Molecular Approach”, Pearson Global Edition, 5th ed.; p.544
- [2] N.J. Tro (2021): “Chemistry - A Molecular Approach”, Pearson Global Edition, 5th ed.; p.548
vorige les \(\quad\) volgende les